

| ▶ ROCK-α studyについて | ▶ FAQ | ▶ 研究概要説明動画 | ▶ 注意事項 |
| 1. | グラアルファ配合点眼液, インタビューフォーム | |
| 2. | 新家 眞, 山崎 芳夫, 杉山 和久, 桑山 泰明, 谷原 秀信. ブリモニジン点眼液の原発開放隅角緑内障または高眼圧症を対象とした長期投与試験. あたらしい眼科; 29: 679-686 | |
| 3. | K-115 Clinical Study Group. One-year clinical evaluation of 0.4% ripasudil (K-115) in patients with open-angle glaucoma and ocular hypertension. Acta Opthalmol. 2016; 94: e26-e34 | |
| 4. | Tanihara H, Kakuda T, Sano T, Kanno T, Kurihara Y. Long-Term Intraocular Pressure-Lowering Effects and Adverse Events of Ripasudil in Patients with Glaucoma or Ocular Hypertension over 24 Months. Adv Ther. 2022; 39: 1659-1677 |
| ①実施体制・背景と目的・目標症例数 | 動画を再生する(クリックで別タブで開きます) |
| ②研究デザイン・評価項目 | 動画を再生する(クリックで別タブで開きます) |
| ③適格基準(選択基準・除外基準) | 動画を再生する(クリックで別タブで開きます) |
| ④観察項目 | 動画を再生する(クリックで別タブで開きます) |
| ⑤同意取得・研究費・問い合わせ | 動画を再生する(クリックで別タブで開きます) |
| ⑥実施のながれ | 動画を再生する(クリックで別タブで開きます) |
新たにリパスジル・ブリモニジン配合点眼液の処方が開始された緑内障患者、高眼圧症患者を対象に、長期間(2年)観察し、リパスジル・ブリモニジン配合点眼液の使用実態下における安全性および有効性を検討すること。
医師主導臨床研究
緑内障患者、高眼圧症患者であって、新たにリパスジル・ブリモニジン配合点眼液の処方が開始された患者
【3-1.選択基準】
(適格性の確認時に以下のすべての項目を満たす患者を本研究の対象とする)
(1)緑内障、高眼圧症の患者
(2)通常診療下で リパスジル・ブリモニジン配合点眼液が処方され、処方開始から8週間以内*に、研究参加の同意が得られた患者
(3)リパスジル・ブリモニジン配合点眼液処方開始前**に眼圧が測定されている患者
*リパスジル・ブリモニジン配合点眼液の処方開始後であれば、同日の同意取得、登録も可とする。
**リパスジル・ブリモニジン配合点眼液処方開始前1週間以内の値とする。
【3-2.除外基準】
(選択基準を満たしていても,以下の条件のいずれかに抵触する患者は本研究の対象としない)
(1)過去にリパスジル・ブリモニジン配合点眼液を使用し、その使用を中断したことのある患者
(2)リパスジルまたはブリモニジンに対し過敏症の既往歴のある患者
(3)低出生体重児、新生児、乳児または2歳未満の幼児
(4)代諾者を要する者
(5)その他担当研究責任者または研究分担者が研究への参加を不適当と判断した者
非侵襲、非介入、前向き観察研究
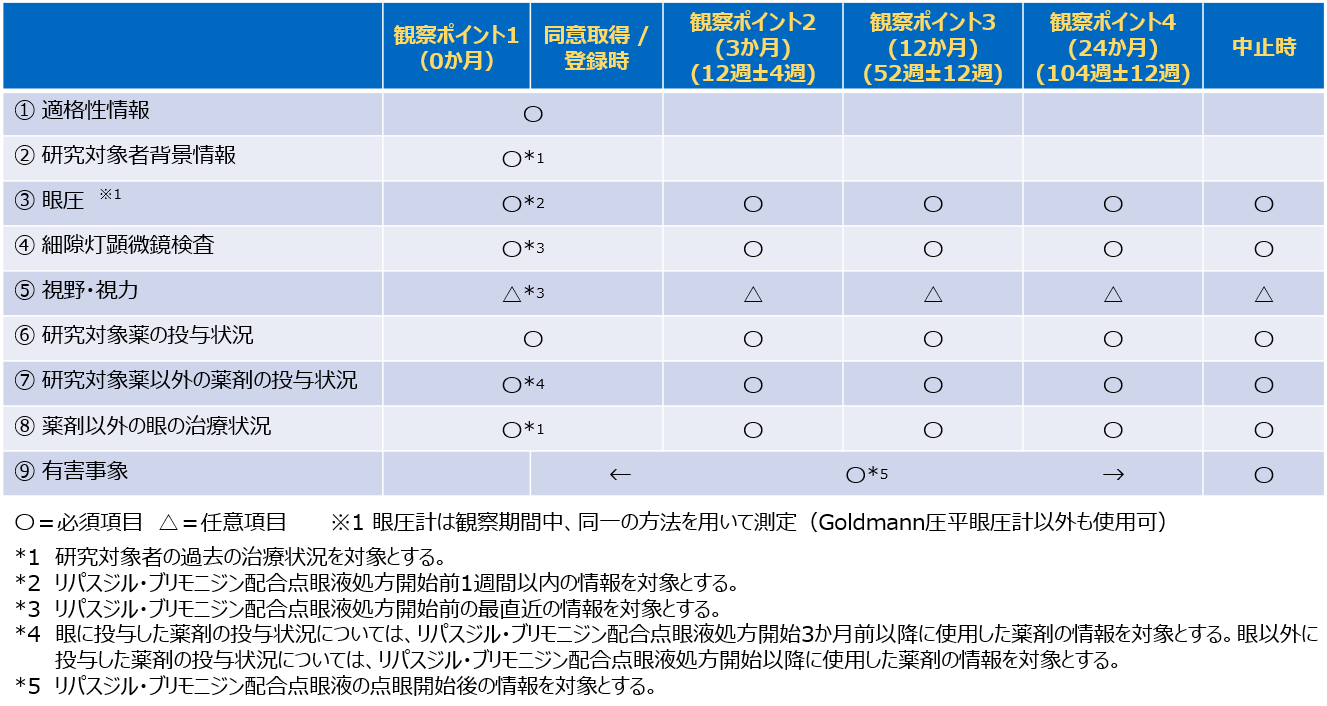
【6-1.研究実施期間】
倫理審査委員会承認日~2027年1月31日まで*
*倫理審査委員会へ研究終了の報告をする日までとして
【6-2.症例登録期間】
倫理審査委員会承認日~2024年5月31日まで
5,000症例
緑内障の治療に対する十分な経験を有する研究責任者および研究分担者が診療を行う、全国約500の医療機関様のご参加を想定しております。
本研究にご参加いただくためには、原則、ROCK-α study groupによる審査と倫理審査委員会(IRB)の審査をうけていただく必要がございます。
<倫理審査委員会の審査について>
本研究では、一つの倫理審査委員会に一括して審査を申請するため、先生方のご所属の医療機関様で設置されているIRBでの審査は必須ではございませんが、ご希望の場合にはお問い合わせ先までご連絡ください。
| ①症例報告書記載時の注意事項 |
| ②重篤な有害事象(SAE)発生時の注意事項 |
ROCK-α study 研究事務局